
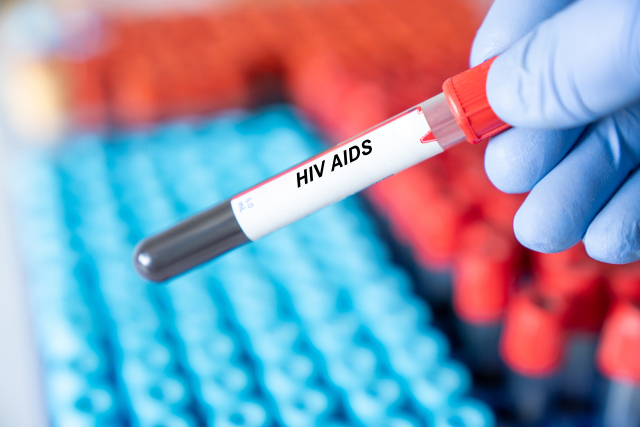
한미약품이 첫 신약으로 허가받은 '올리타'(성분명 올무티닙) 개발을 전격 중단하기로 했다. 지난해 식약처로부터 임상 3상을 허가받았지만, 환자 모집이 미미해 3상을 시작하지 못한 탓이다.
한미약품은 식약처에 올리타의 개발 및 판매를 중단한다는 계획서를 제출하고, 향후 절차에 대한 식약처와의 협의를 시작했다고 13일 밝혔다.
한미약품과 식약처는 현재 올리타 임상시험에 참여하거나 처방받아 복용 중인 환자들이 불편이 없도록 조치할 예정이다. 한미약품 역시 환자들이 진료를 이어갈 수 있도록 일정 기간 공급을 지속하기로 했다.
올리타는 한미약품이 자체 개발한 진행성 또는 전이성 비소세포폐암 표적치료제다. 기존 항암제에 내성이 생겨 더는 쓸 치료제가 없는 비소세포폐암 환자에 쓴다. 2016년 5월 식품의약품안전처로부터 임상 3상 시험을 전제로 27번째 국산 신약으로 허가받았다. 한미약품이 자체 개발해 허가받은 첫 신약이기도 하다.
한미약품은 올리타 개발을 중단한 이유에 대해 경쟁 약물인 아스트라제네카의 '타그리소'가 전 세계 40여개국에서 판매되고 있어 올리타의 임상 3상 진행이 어려워졌기 때문이라고 주장했다. 제약업계에서는 한미약품이 막대한 자금이 투여되는 임상 3상 시행을 앞두고 나름의 전략적 판단을 내린 것으로 보고 있다.
식약처는 한미약품이 임상시험 진행 어려움 등의 이유로 올리타의 개발 및 판매중단 계획서를 제출한 사실을 확인했다고 밝혔다. 식약처는 이달 말까지 올리타 임상시험에 참여하거나 처방받아 투여 중인 환자, 앞으로 다른 의약품으로 변경할 환자 등에 대한 안전조치 계획을 검토할 예정이다.
복지부는 환자가 원하는 경우 타그리소 등과 같은 대체 의약품으로 전환할 수 있도록 하겠다고 밝혔다. 약물을 변경해도 건강보험 급여를 지속해서 받을 수 있도록 조치할 예정이다.





























댓글 많은 뉴스
장동혁 대표 체제 힘 실은 TK 의원들
李대통령, 이학재 겨냥? "그럼 '사랑과 전쟁'은 바람피는 법 가르치나"
장동혁 "당명 바꿀 수도"…의원 50여명 만나며 '쇄신 드라이브'
李대통령 "내가 종북이면 박근혜는 고첩…과거 朴정부도 현금지원했다"
이학재, 李 "댓글 보니 세관 아니라 인천공항공사 업무" 발언에 "위탁 받은 적 없다" 반박